Stellen Sie sich vor, es geht Ihnen oder Ihrem Kind schlecht und dennoch wird erst nach Monaten oder Jahren und etlichen Arztwechseln die Krankheit korrekt diagnostiziert. Stellen Sie sich vor, dass es dann trotzdem keine Therapie für diese Krankheit gibt. Stellen Sie sich vor, dass Bekannte oder Familienangehörige, die Schulkamerad*innen Ihres Kindes oder Ihre Kolleg*innen ratlos im Umgang mit dieser Krankheit sind. Und stellen Sie sich vor, dass Sie Hunderte von Kilometern fahren müssen, um Ihr Kind oder sich selbst von ein*er der wenigen Spezialist*innen für diese Krankheit behandeln zu lassen.
So sieht oft der Alltag von Betroffenen aus, die an einer der geschätzt 8.000 seltenen Erkrankungen leiden. In Europa gilt eine Erkrankung als selten, wenn nicht mehr als 5 von 10.000 Menschen das spezifische Krankheitsbild aufweisen.
Die ACHSE hilft
Ihre Interessen vertritt unter anderem die „ACHSE“. ACHSE e.V. ist ein Netzwerk von Selbsthilfeorganisationen und tritt als Sprachrohr, Multiplikator und Vermittler auf. Es hilft Betroffenen und Angehörigen und fördert das Wissen über diese Erkrankungen in der Bevölkerung, bei Interessenvertreter*innen in Politik und Organisationen, aber auch bei Ärzt*innen und Therapeut*innen. Ebenso stößt die ACHSE Forschung über seltene Erkrankungen an.
Novartis unterstützt die Arbeit der ACHSE seit vielen Jahren. Als forschendes Arzneimittelunternehmen untersucht Novartis auch einige seltene Erkrankungen, bei denen wir uns für die Patient*innen engagieren. Hier ein paar ausgewählte Beispiele:
Erkrankungen, die den Nieren schaden
IgA-Nephropathie | seltene-nierenerkrankungen.de
Eine chronische Entzündung schadet dem Körper immer und in vielen Fällen sehr massiv. Eines von etlichen markanten Beispielen ist die sogenannte IgA-Nephropathie (kurz IgAN; IgA steht für Immunglobulin A) – eine Krankheit der Nieren, die durch eine Fehlregulation im Komplementsystem der Immunabwehr entsteht. Ursache sind vermutlich sowohl genetische als auch Umweltfaktoren.1,2 Die Erkrankung betrifft einen ganz bestimmten Teil der Nieren, die Nierenkörperchen. Ihre Aufgabe es ist, das Blut zu filtern. Im Zuge der Erkrankung lagern sich in den Nierenkörperchen sogenannte Immunkomplexe ab, die Antikörper vom Typ IgA enthalten. Durch diese Ablagerungen kommt es zu einer fortlaufenden Entzündung und daraus folgenden Nierenschäden.1,2 Die IgAN ist die häufigste Erkrankung der Nierenkörperchen in Europa: Jedes Jahr werden 8 bis 25 Erwachsene pro 1 Million Menschen über 18 Jahre und 3 bis 5 von 1 Million Kinder neu mit IgAN diagnostiziert.3 Eine sichere Diagnose kann nur ein Facharzt oder eine Fachärztin mithilfe einer Gewebeentnahme (Biopsie) aus den Nieren stellen.2
Die Erkrankung kann sehr unterschiedlich verlaufen und beginnt meist schleichend. Es gibt aber auch schnell fortschreitende Verläufe, die früh zu einem Verlust der Nierenfunktion führen können.4 Risikofaktoren und gleichzeitig Symptome eines raschen Fortschreitens sind Bluthochdruck und eine hohe Eiweißausscheidung im Urin (Proteinurie).5 Vielfach wird die IgAN nur zufällig und/oder erst in einem fortgeschrittenen Stadium entdeckt.4 Doch 10 bis 20 Jahre nach der Diagnose versagt bei circa einem Drittel der Patient*innen die Nierenfunktion.5 Sie werden dialysepflichtig. Ihr Blut muss also regelmäßig maschinell gereinigt werden, weil ihre Nieren durch die Erkrankung zu sehr geschädigt wurden. Vielen Patient*innen droht ein Verlust der Nieren.1,4,5
Zur Therapie gehören zum einen diätische und Lifestyle-Maßnahmen wie eine salzarme Ernährung oder der Verzicht aufs Rauchen, zum anderen eine supportive medikamentöse Behandlung z. B. der Bluthochdruck Proteinurie.4 Seit Kurzem sind auch spezifisch für die IgAN zugelassene Therapien verfügbar.
Referenzen
- Amann K, et al. Nierenerkrankungen im Kindes- und Jugendalter 2017;69-123.
- Appel GB. IgA Nephropathy: Clinical Features, Pathogenesis, and Treatment. In: Trachtman H, et al. Glomerulonephritis. Springer. 2019;368-380.
- Coppo R. Kidney Dis. 2018;4(2):58-64.
- Sommerer C. Hessisches Ärzteblatt. 2020;06:340-346.
- Habas E, et al. Medicine. 2022;101:48(e31219).
C3-Glomerulopathie
Eine andere chronische Entzündungserkrankung der Nieren ist unter dem Namen C3-Glomerulopathie bzw. C3G (für „Complementfactor 3 Glomerulopathy“) bekannt. Jährlich erkranken weltweit schätzungsweise 1 bis 2 von 1 Million Menschen neu an C3G.1 Sie kann Menschen aller Altersgruppen betreffen, meist jedoch junge Erwachsene.2 Patient*innen berichten davon, dass sie körperlich und funktionell eingeschränkt sind und zudem unter der emotionalen Belastung durch ihre Erkrankung leiden. Zu den häufigsten Beschwerden zählen Müdigkeit, Erschöpfung, Wassereinlagerungen und Kopfschmerzen sowie eine erhöhte Infektanfälligkeit.2 Eine sichere Diagnose der C3G ist nur durch eine Nierenpunktion (Biopsie) möglich.3
Die C3G wird durch eine Fehlregulation im Komplementsystem der Immunabwehr ausgelöst. Das Komplementsystem besteht aus über 50 Proteinen und Proteinfragmenten, die im Blut „schwimmen“ oder an Körperzellen gebunden sind und kaskadenartig aktiviert werden, sobald ein Krankheitserreger auftaucht.3 Am Ende der Kaskade steht ein aggressiver Angriffskomplex, der Viren, Bakterien oder Pilze direkt zerstören kann.3 Zusätzlich aktiviert das Komplement auch die restlichen Komponenten unseres Immunsystems.4
Bei der C3G wird das Komplementsystem übermäßig aktiviert, was zur Ablagerung des C3-Proteins in den Nierenkörperchen führt. Das wiederum zieht Entzündungen und eine Schädigung des Nierengewebes nach sich. Die Folge: Die Nieren arbeiten nicht mehr ordnungsgemäß.3,5,6 Etwa die Hälfte der Patient*innen entwickelt innerhalb von zehn Jahren nach der Diagnose ein Nierenversagen.7 Ihr Blut muss dann regelmäßig maschinell mit einer Dialyse gereinigt werden. Zudem erleben Betroffene oft einen Organverlust und sind auf eine Nierentransplantation angewiesen.7,8 Das Risiko für ein Nierenversagen kann verringert werden, indem die Proteinurie – also ein erhöhter Eiweiß-Wert im Urin – und der Blutdruck gesenkt werden.3 Eine spezifische Therapieoption für die C3G gibt es jedoch nicht.3
Referenzen
- Schena FP, et al. Int J Mol Sci. 2020;21(2):525.
- Feldman DL, et al. Voice of the Patient: Report of Externally Led Patient-Focused Drug Development Meeting on Complement 3 Glomerulopathy (C3G). National Kidney Foundation; 2018.
- Smith RJH, et al. Nat Rev Nephrol. 2019;15(3):129-143.
- Kirschfink M, et al. Pädiatrie 2014;738-743.
- Amann K, et al. Nierenerkrankungen im Kindes- und Jugendalter 2017;69-123.
- Zipfel PF, et al. Der Nierenarzt 2020;7(16);8-13.
- Goodship TH, et al. Kidney Int 2017;91(3):539-551.
- www.nierenstiftung.de/fuer-betroffene/niere-a-bis-z/nierenersatzverfahren (zuletzt aufgerufen am 20.02.2025).
aHUS: Blutgerinnsel bilden sich im Körper
Das atypische hämolytisch-urämische Syndrom (aHUS) ist sehr selten: Jährlich erkrankt weniger als 1 unter 1 Million Menschen daran. Die Erkrankung kann in allen Altersgruppen auftreten.1 Im Kindesalter sind Jungen und Mädchen etwa gleich häufig betroffen. Unter den Erwachsenen erkranken Frauen häufiger als Männer.2
Ähnlich wie bei der C3G liegt auch beim aHUS eine Fehlregulation des Komplementsystems vor. Als Risikofaktoren gelten genetische Veränderungen, die angeboren sind oder im Laufe des Lebens erworben werden können. Doch damit die Krankheit ausbricht, wird häufig ein Auslöser (auch „Trigger“ genannt) benötigt. Dieser kann beispielsweise eine Infektion, Immunerkrankung, Medikation, Operation oder Schwangerschaft sein.1,3
aHUS ist eine fortschreitende, lebensbedrohliche Form der thrombotischen Mikroangiopathie (TMA). Bei dieser werden kleine Blutgefäße geschädigt, wodurch sich gefährliche Blutgerinnsel bilden können, die die Durchblutung der Niere und anderer lebenswichtiger Organe beeinträchtigen.4 Die Symptome sind unterschiedlich und können plötzlich oder allmählich auftreten. Charakteristisch ist eine Dreizahl aus Blutarmut, Blutplättchenmangel und akutem Nierenversagen.4 Je nach betroffenem Organ sind neben Müdigkeit verschiedene weitere Anzeichen möglich, wie beispielsweise Schmerzen im Unterleib, Wassereinlagerungen und Krampfanfälle.2 Heute sind zur Behandlung von aHUS spezifische Therapieoptionen verfügbar, zu denen Komplementinhibitoren zählen. Sie hemmen die anhaltende, unkontrollierte Aktivierung des Komplementsystems und sind längst Standardtherapie.3,4
Referenzen
- Wong EKS, Kavanagh D. Semin Immunopathol. 2018;40(1):49-64.
- Selbsthilfe für seltene komplementvermittelte Erkrankungen e.V. aHUS. https://www.ahus-selbsthilfe.de/erkrankungen/ahus/ (zuletzt aufgerufen am 20.02.2024).
- Reyes LC, Saland JM. Hemolytic Uremic Syndrome, Genetic. In: Trachtman H, et al. Glomerulonephritis. Springer. 2019;667-679.
- Kaplan BS, et al. Intractable Rare Dis Res 2014;3(2):34-45.
Die spinale Muskelatrophie
Etwa 1 von 7.500 Neugeborenen wird mit dieser seltenen erblichen Erkrankung geboren.1,2 Bei der schwersten Form, der SMA Typ 1 erleben unbehandelt 9 von 10 Kindern ihren zweiten Geburtstag nicht oder sie müssen dauerbeatmet werden.3,4 Die Ursache ist der Defekt eines einzigen Gens.4,5 Bei dieser Erkrankung ist eine frühe Diagnose und Behandlung entscheidend für den weiteren Verlauf. Deshalb hat der Gemeinsame Bundesausschuss der Krankenkassen die Aufnahme der Erkrankung in das Screening von Neugeborenen seit Oktober 2021 flächendeckend umgesetzt.6 Erst seit 2017 gibt es überhaupt medikamentöse Behandlungsmöglichkeiten: der entscheidende Unterschied für Patient*innen, ihre Angehörigen und Ärzt*innen. Novartis setzt sich für die Aufklärung über diese Erkrankung ein und unterstützt betroffene Familien mit Informationsmaterialien.
Referenzen
- Vill K, et al. J Neuromuscul Dis 2019;6(4):503–15.
- Müller-Felber W et al. Monatsschr Kinderheilkd 2024;172(7):595–600.
- Darras BT. Spinal muscular atrophies. Pediatr Clin North Am 2015;62(3):743–66
- Nishio H, et al. Spinal Muscular Atrophy: The Past, Present, and Future of Diagnosis and Treatment. Int J Mol Sci 2023;24(15).
- Kolb SJ, Kissel JT. Spinal Muscular Atrophy. Neurol Clin 2015;33(4):831–46.
- https://www.g-ba.de/presse/pressemitteilungen-meldungen/919/ (zuletzt aufgerufen am 20.02.2025).
Weitere seltene Erkrankungen, für deren Behandlung sich Novartis engagiert
Mehr als nur Fieber
Das Familiäre Mittelmeerfieber (FMF) tritt meist bei Menschen auf, die aus dem östlichen Mittelmeerraum stammen.1 Bei FMF und anderen seltenen autoinflammatorischen Erkrankungen entstehen im Körper immer wieder „von selbst“ Entzündungen – ohne vorherige Ansteckung mit Krankheitserregern. Dies hat typischerweise wiederkehrende Fieberattacken zur Folge, die von Bauch- und/oder Brustschmerzen und Gelenkentzündungen begleitet werden.1 Eine frühzeitige Diagnose ist wichtig, da das FMF unheilbar ist. Mit einer geeigneten Therapie können die Krankheitsschübe jedoch gut kontrolliert und schwerwiegende Spätfolgen wie Gelenkschäden oder Nierenversagen vermieden werden.2
Referenzen
- https://www.autoinflammation.de/erkrankungen/autoinflammatorische-erkrankungen (zuletzt aufgerufen am 20.02.2025).
- https://klinikradar.de/familiaeres-mittelmeerfieber-fmf (zuletzt aufgerufen am 20.02.2025).
Licht ins Dunkel bringen – Gendiagnostik in der Augenheilkunde
Erbliche Netzhauterkrankungen können schon Säuglinge treffen. Infolge von Veränderungen im genetischen Bauplan der Zellen werden wichtige Prozesse im Auge gestört.1-3 Die lichtempfindlichen Sehzellen in der Netzhaut verkümmern meist nach und nach. Dies kann schon im frühen Erwachsenenalter bis zur vollständigen Erblindung führen.4,5 Als Ergänzung zu gängigen augenärztlichen Untersuchungen ist die Gendiagnostik bei diesen Erkrankungen besonders wichtig. Nicht immer lässt sich aufgrund von Symptomen und Untersuchungsergebnissen die genaue Form der Netzhauterkrankung bestimmen. Gerade in späteren Krankheitsstadien ist häufig schwer nachvollziehbar, zu welchem Zeitpunkt die Erkrankung begonnen hat und was die ersten Symptome waren – diese Informationen sind jedoch wichtig für die Diagnose. Erst die Einordnung durch einen Gentest kann die Diagnose mit hoher Wahrscheinlichkeit sichern oder eingrenzen.6 Rund 7 Prozent aller jährlichen Neuerblindungen in Deutschland sind auf eine erbliche Netzhauterkrankung zurückzuführen.7
Referenzen
- Russell S, et al. Lancet 2017;390(10097):849–860.
- Kellner U, et al. Klin Monatsbl Augenheilkd 2012;229:173–196.
- https://www.orpha.net/data/patho/Pub/Ext/de/VitreoretinaleKrankheit_PUB_DE_de_ORPHA98657.pdf. (zuletzt aufgerufen am 20.02.2025).
- https://www.erbliche-netzhauterkrankungen.de/arten-und-symptome/symptome (zuletzt aufgerufen am 20.02.2025).
- Astuti GD, et al. Eur J Hum Genet 2016;24:1071–1079
- Bolz HJ. Klin Monatsbl Augenheilkd 2017;234:280–288.
- Finger R, et al. Dt Ärzteblatt 2012;27–28(109):484–489.
Die paroxysmale nächtliche Hämoglobinurie (PNH)
ist eine seltene, chronische Blutkrankheit, die weltweit schätzungsweise etwa 10 bis 20 pro 1 Million Menschen betrifft.1 Sie tritt meist zwischen dem 25. und 45. Lebensjahr auf und entsteht im Lebensverlauf durch eine erworbene Genmutation von Blutstammzellen.2,3
Infolgedessen fehlen den roten Blutzellen (Erythrozyten) bestimmte Proteine auf der Oberfläche, wodurch sie vom Komplementsystem – einem Teil des angeborenen Immunsystems – zerstört werden. Der beim Zerfall freigesetzte rote Blutfarbstoff (Hämoglobin) wird über den Urin ausgeschieden (Hämoglobinurie). Eine anfallsartige (paroxysmale) – nicht nur nächtliche –Dunkelfärbung des Urins ist möglich.2,3
Symptome und Verlauf variieren. Im Vordergrund steht meist eine ausgeprägte Erschöpfung (Fatigue), die ca. 80 Prozent der Patient*innen betrifft. Weitere mögliche Symptome sind unter anderem Blutarmut oder Blutgerinnsel (Thrombosen).2-4
Die Behandlung richtet sich nach Beschwerden und Symptomen der Betroffenen. Eine potenziell heilende Stammzelltransplantation ist Extremfällen mit schweren Blutbildungsstörungen vorbehalten und mit einem hohen Sterberisiko verbunden. Generell eingesetzte unterstützende Maßnahmen ergänzen die Standardtherapie mit einem Inhibitor des Komplementsystems.4
Referenzen
- Cançado RD, et al. Hematol Transfus Cell Ther. 2021;43(3):341-348.
- Wong EKS, Kavanagh D. Semin Immunopathol 2018;40(1):49–64.
- Röth A, Dührsen U. Dtsch Arztebl 2007;104(4):A192-A197.
- Schubart J, et al. Onkopedia Leitlinie. Paroxysmale nächtliche Hämoglobinurie (PNH). Stand: September 2024. https://www.onkopedia.com/de/onkopedia/guidelines/paroxysmale-naechtlic… (zuletzt aufgerufen am 20.02.2025).
Zu viele weiße Blutkörperchen im Blut
Die Chronische myeloische Leukämie (CML) ist eine seltene Form von Blutkrebs.
Bei den Betroffenen kommt es zu einer starken Vermehrung von weißen Blutkörperchen (Leukozyten) im Knochenmark. Die weißen Blutkörperchen werden vom Knochenmark – dem Ort, an dem sie produziert werden – ins Blut geschwemmt.1
Bei der CML ist eine spezielle Unterart der weißen Blutkörperchen betroffen, die Granulozyten. Granulozyten sind Teil des Immunsystems und greifen Krankheitserreger im Blut an, um sie unschädlich zu machen.2
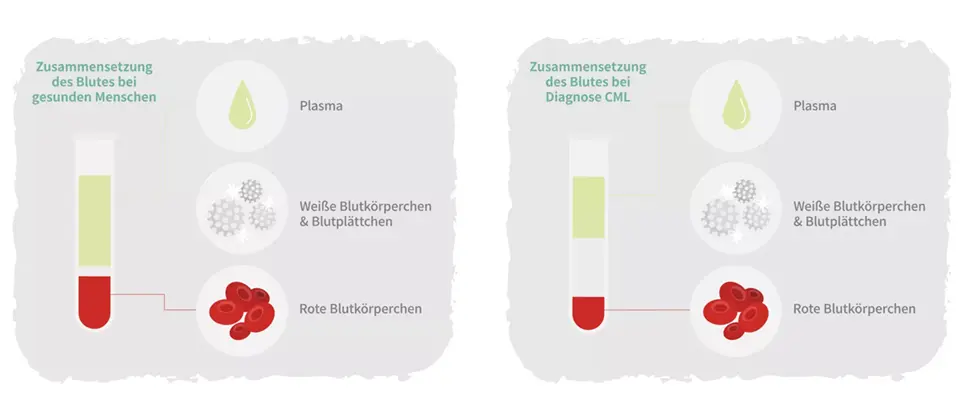
In Deutschland erkranken pro Jahr etwa 1.000 bis 1.200 Menschen an einer CML.4 Die Erkrankung kann in jeder Altersgruppe auftreten, am häufigsten sind jedoch Menschen zwischen dem 55. und 60. Lebensjahr betroffen. In über 95 Prozent der Fälle ist die Ursache ein bestimmter Gendefekt, der auch als Philadelphia-Chromosom bezeichnet wird.4
Referenzen
- https://www.krebsinformationsdienst.de/tumorarten/leukaemien/einteilung.php (zuletzt aufgerufen am 20.02.2025).
- https://flexikon.doccheck.com/de/Granulozyt (zuletzt aufgerufen am 20.02.2025).
- https://www.leben-mit-blutkrankheiten.de/blutkrankheiten/cml/krankheitsbild (zuletzt aufgerufen am 20.02.2025).
- Hochhaus A, et al. Onkopedia Leitlinie. Chronische Myeloische Leukämie (CML). Stand: Juni 2018. https://www.onkopedia.com/de/onkopedia/guidelines/chronische-myeloische… (zuletzt aufgerufen am 20.02.2025).



